[高一化学必修1第一章的总结]第一章 从实验学化学小结 一、化学实验基本方法 1、过滤 A、作用:分离固体(不溶性固体)和液体。 B、操作要点:一贴(滤纸与漏斗内壁紧贴) , 二低(滤纸边缘低于漏斗边缘;溶液液面低于滤...+阅读
转抄;第一章 从实验学化学-1- 化学实验基本方法 过滤 一帖、二低、三靠 分离固体和液体的混合体时,除去液体中不溶性固体。(漏斗、滤纸、玻璃棒、烧杯) 蒸发 不断搅拌,有大量晶体时就应熄灯,余热蒸发至干,可防过热而迸溅 把稀溶液浓缩或把含固态溶质的溶液干,在蒸发皿进行蒸发 蒸馏 ①液体体积②加热方式③温度计水银球位置④冷却的水流方向⑤防液体暴沸 利用沸点不同除去液体混合物中难挥发或不挥发的杂质(蒸馏烧瓶、酒精灯、温度计、冷凝管、接液管、锥形瓶) 萃取 萃取剂:原溶液中的溶剂互不相溶;② 对溶质的溶解度要远大于原溶剂;③ 要易于挥发。
利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,主要仪器:分液漏斗 分液 下层的液体从下端放出,上层从上口倒出 把互不相溶的两种液体分开的操作,与萃取配合使用的 过滤器上洗涤沉淀的操作 向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次 配制一定物质的量浓度的溶液 需用的仪器 托盘天平(或量筒)、烧杯、玻璃棒、容量瓶、胶头滴管 主要步骤:⑴ 计算 ⑵ 称量(如是液体就用滴定管量取)⑶ 溶解(少量水,搅拌,注意冷却)⑷ 转液(容量瓶要先检漏,玻璃棒引流)⑸ 洗涤(洗涤液一并转移到容量瓶中)⑹ 振摇⑺ 定容⑻ 摇匀 容量瓶 ①容量瓶上注明温度和量程。
②容量瓶上只有刻线而无刻度。 ①只能配制容量瓶中规定容积的溶液;②不能用容量瓶溶解、稀释或久贮溶液;③容量瓶不能加热,转入瓶中的溶液温度20℃左右 第一章 从实验学化学-2- 化学计量在实验中的应用 1 物质的量 物质的量实际上表示含有一定数目粒子的集体 2 摩尔 物质的量的单位 3 标准状况 STP 0℃和1标准大气压下 4 阿伏加德罗常数NA 1mol任何物质含的微粒数目都是6.02*1023个 5 摩尔质量 M 1mol任何物质质量是在数值上相对质量相等 6 气体摩尔体积 Vm 1mol任何气体的标准状况下的体积都约为22.4l7 阿伏加德罗定律 (由PV=nRT推导出) 同温同压下同体积的任何气体有同分子数 n1 N1 V1 n2 N2 V28 物质的量浓度CB 1L溶液中所含溶质B的物质的量所表示的浓度 CB=nB/V nB=CB*V V=nB/CB9 物质的质量 m m=M*n n=m/M M=m/n10 标准状况气体体积 V V=n*Vm n=V/Vm Vm=V/n11 物质的粒子数 N N=NA*n n =N/NA NA=N/n12 物质的量浓度CB与溶质的质量分数ω 1000*ρ*ω M13 溶液稀释规律 C(浓)*V(浓)=C(稀)*V(稀) 以物质的量为中心 第二章 化学物质及变化-1-物质的分类 1 元素分类: 金属和非金属元素2 化合物分类: 有机物(含C)和无机物 氧化物 酸性氧化物(与碱反应生成盐和水) SiO2、SO2、CO2、SO3、N2O5、(多数为非金属氧化物) 碱性氧化物(与酸反应生成盐和水) Fe2O3、CuO 、 MgO (多数为金属氧化物)、 两性氧化物(与酸、碱反应生成盐和水) Al2O3、ZnO 不成盐氧化物 NO2、NO、CO、 (盐中的N的化合价无+2、+3、C无+2) 分散系 溶液(很稳定) 分散质粒子小于1nm,透明、稳定、均一 胶体(介稳定状态) 分散质粒子1nm-100nm,较透明、稳定、均一 浊液(分悬、乳浊液) 分散质粒子大于100nm,不透明、不稳定、不均一 化学反应的分类 四大基本反应类型 化合:2SO2+ O2 2SO3 分解:2NaHCO3 Na2CO3 +CO2↑+ H2O 置换:Cl2 +2KI ===2KCl+I2 复分解:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 是否有离子参加反应(电解质在水溶液中) 离子反应:Cl2+H2O = HCl+HClO 非离子反应:2Fe+3Cl2 2FeCl3 是否有元素电子得失或偏移(有升降价) 氧化还原反应:2Na+2H2O=2NaOH+H2↑ 非氧化还原反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 热量的放出或吸收 放热反应:3Fe+2O2 Fe3O4 吸热反应:C+CO2 2CO 第二章 化学物质及变化-2-离子反应 电解质(酸、碱、盐、水) 在水溶液里或熔融状态下本身能够导电的化合物 非电解质(包括CO2、SO2) 在水溶液里或熔融状态下不能够导电的化合物 碳酸的电离方程式 H2CO3 H++HCO3- (弱电解质用“ ” NaHCO3的电离方程式 NaHCO3=Na++HCO3- (强电解质用“ = ” 离子反应式 用实际参加反应的离子所表示的式子 离子反应式写法 一写、二改、三删、四查 单质、氧化物、气体、难溶、难电离的物质要保留分子式 离子共存 有颜色的离子 MnO4-紫红、Fe3+棕黄、Fe2+浅绿、Cu2+蓝色 与H+不共存(弱酸根) OH-、CO32-、SO32-、SiO32-、AlO2-、S2-、F- 等 与OH-不共存(弱碱金属阳离子) H+、Fe3+、Fe2+、Fe3+、Cu2+、Al3+、Mg2+、NH4+ 等 与H+和OH-都不共存 HCO3-、HSO3-、HS-、 等 常见生成沉淀 Ba2+、Ca2+与SO42-、CO32- Ag+与Cl- 胶体 胶体的性质(介稳定) 丁达尔现象、布朗运动、电泳、聚沉 判断胶体最简单的方法 丁达尔现象 胶体提纯 渗析(胶体微粒不能透过半透膜) Fe(OH)3胶体制备的方法 取烧杯盛20mL蒸馏水,加热至沸腾,然后逐滴加入饱和FeCl3溶液1mL~2mL。
继续煮沸至溶液呈红褐色。观察所得红褐色液体Fe(OH)3胶体。 Fe(OH)3胶体制备方程式 FeCl3+3H2O Fe(OH)3(胶体)...
延伸阅读:
高中数学知识点大全高中高一数学必修1各章知识点总结 第一章 集合与函数概念 一、集合有关概念 1、集合的含义:某些指定的对象集在一起就成为一个集合,其中每一个对象叫元素 2、集合的中元素的三...
高中数学知识点详细总结高中数学重点有什么?该怎样攻克? 高中数学重点内容还有很多.这些重点都是保持多年来的经验,他们分析过高考数学的题型,高中数学重点分为以下几个部分. 高中数学知识 一、函数和...

高中数学必须五知识点总结必修五知识点总结归纳必修五知识点总结归纳必修五知识点总结归纳必修五知识点总结归纳 ((( (一一一一))))解三角形解三角形解三角形解三角形 1、正弦定理:在C∆ΑΒ中,a、b、c分别为角...
高一数学知识点高一数学知识总结必修一 一、集合 一、集合有关概念 1. 集合的含义 2. 集合的中元素的三个特性: (1)元素的确定性如:世界上最高的山 (2)元素的互异性如:由HAPPY的字母组成的集合{H,...
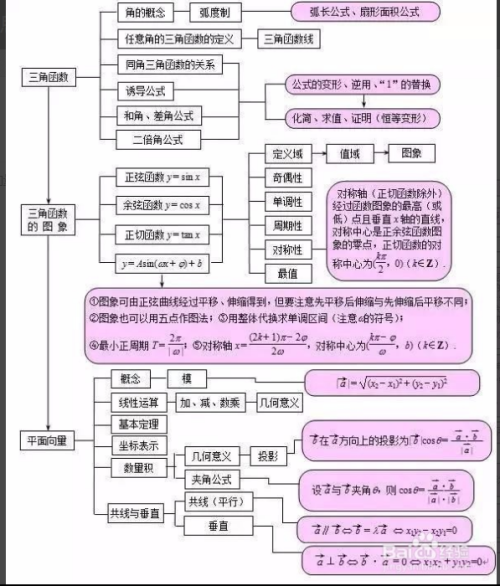
高中数学必修四第一章知识点思维导图急急急急送上三角函数以及平面向量的思维导图 必修4知识点总结如下:...
高中数学知识点总结复数是高中代数的重要内容,在高考试题中约占8%-10%,一般的出一道基础题和一道中档题,经常与三角、解析几何、方程、不等式等知识综合.本章主要内容是复数的概念,复数的代数、几...
高一数学必修一知识点总结高一数学必修1第一章知识点总结 一、集合有关概念1. 集合的含义2. 集合的中元素的三个特性: (1) 元素的确定性, (2) 元素的互异性, (3) 元素的无序性, 3.集合的表示:{ … } 如:{我校的篮...
高一数学知识点总结*这是高中数学的全部公式* 三角函数公式表 同角三角函数的基本关系式 倒数关系: 商的关系: 平方关系: tanα ·cotα=1 sinα ·cscα=1 cosα ·secα=1 sinα/cosα=tanα=se...
高中生物必修一二三的知识结构总结框架图简单明了第一章:人体的内环境与稳态 1、体液:体内含有的大量以水为基础的物体。 细胞内液(2/3) 体液 细胞外液(1/3):包括:血浆、淋巴、组织液等 2、体液之间关系: 血浆 细胞内液 组织液 淋巴...





