[人教版高中物理选修32楞次定律课后习题详解急!]人教版高中物理选修3-2课后习题参考答案 课后练习一 第 1 讲 电磁感应和楞次定律 1. 答案:CD 详解:导体棒做匀速运动,磁通量的变化率是一个常数,产生稳恒电流,那么被线圈缠绕的磁...+阅读
高中化学选修4
《化学反应原理》知识点总结 第一章:化学反应与能量变化
1、反应热与焓变:△H=H(产物)-H(反应物)
2、反应热与物质能量的关系
3、反应热与键能的关系 △H=反应物的键能总和-生成物的键能总和
4、常见的吸热、放热反应 ⑴常见的放热反应: ①活泼金属与水或酸的反应 ②酸碱中和反应 ③燃烧反应 ④多数的化合反应⑤铝热反应 ⑵常见的吸热反应 ①多数的分解反应 ②2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3+10H2O ③ C(s)+ H2O(g) CO+H2 ④CO2+ C2 CO
5、反应条件与吸热、放热的关系:反应是吸热还是放热与反应的条件没有必然的联系,而取决与反应物和产物具有的总能量(或焓)的相对大小。
6、书写热化学方程式除了遵循书写化学方程式的要求外,还应注意以下几点: ①放热反应△H为“-”,吸热反应△H为“+”,△H的单位为kJ/mol ②反应热△H与测定条件(温度、压强等)有关,因此应注意△H的测定条件;绝大多数化学反应的△H是在298K、101Pa下测定的,可不注明温度和压强。 ③热化学方程式中各物质化学式前面的系数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是分数或小数。必须注明物质的聚集状态,热化学方程式是表示反应已完成的数量,所以方程式中化学式前面的计量数必须与△H相对应;当反应逆向进行时,反应热数值相等,符号相反。
7、利用盖斯定律进行简单的计算
8、电极反应的书写: 活性电极:电极本身失电子 ⑴电解:阳极:(与电源的正极相连)发生氧化反应 惰性电极:溶液中阴离子失电子 (放电顺序:I->Br->Cl->OH-) 阴极:(与电源的负极相连)发生还原反应,溶液中的阳离子得电子 (放电顺序:Ag+>Cu2+>H+) 注意问题:①书写电极反应式时,要用实际放电的离子来表示 ②电解反应的总方程式要注明“通电” ③若电极反应中的离子来自与水或其他弱电解质的电离,则总反应离子方程式中要用化学式表示 ⑵原电池:负极:负极本身失电子,M→Mn+ +ne- ① 溶液中阳离子得电子 Nm++me-→N 正极: 2H++2e-→H2↑ ②负极与电解质溶液不能直接反应:O2+4e-+2H2O→4OH- (即发生吸氧腐蚀) 书写电极反应时要注意电极产物与电解质溶液中的离子是否反应,若反应,则在电极反应中应写最终产物。
9、电解原理的应用: ⑴氯碱工业:阳极(石墨):2Cl-→Cl2+2e-( Cl2的检验:将湿润的淀粉碘化钾试纸靠近出气口,试纸变蓝,证明生成了Cl2)。 阴极:2H++2e-→H2↑(阴极产物为H
2、NaOH。现象(滴入酚酞):有气泡逸出,溶液变红)。 ⑵铜的电解精炼:电极材料:粗铜做阳极,纯铜做阴极。电解质溶液:硫酸酸化的硫酸铜溶液 ⑶电镀:电极材料:镀层金属做阳极(也可用惰性电极做阳极),镀件做阴极。电解质溶液是用含有镀层金属阳离子的盐溶液。
10、化学电源 ⑴燃料电池:先写出电池总反应(类似于可燃物的燃烧); 再写正极反应(氧化剂得电子,一般是O2+4e-+2H2O→4OH-(中性、碱性溶液) O2+4e-+4H+→2H2O(酸性水溶液)。负极反应=电池反应-正极反应(必须电子转移相等) ⑵充放电电池:放电时相当于原电池,充电时相当于电解池(原电池的负极与电源的负极相连,做阴极,原电池的正极与电源的正极相连,做阳极),
11、计算时遵循电子守恒,常用关系式:2 H2~ O2~2Cl2~2Cu~4Ag~4OH-~4H+~4e-
12、金属腐蚀:电解阳极引起的腐蚀>原电池负极引起的腐蚀>化学腐蚀>原电池正极>电解阴极 钢铁在空气中主要发生吸氧腐蚀。负极:2Fe→2Fe 2++4e- 正极:O2+4e-+2H2O→4OH- 总反应:2Fe + O2+2H2O=2Fe(OH)2 第二章:化学反应的方向、限度和速度
1、反应方向的判断依据:△H-T△S0反应不能自发。该判据指出的是一定条件下,自发反应发生的可能性,不能说明实际能否发生反应(计算时注意单位的换算)课本P40T3
2、化学平衡常数: ①平衡常数的大小反映了化学反应可能进行的程度,平衡常数越大,说明反应进行的越完全。②纯固体或纯溶剂参加的反应,它们不列入平衡常数的表达式 ③平衡常数的表达式与化学方程式的书写方式有关,单位与方程式的书写形式一一对应。对于给定的化学反应,正逆反应的平衡常数互为倒数 ④化学平衡常数受温度影响,与浓度无关。温度对化学平衡的影响是通过影响平衡常数实现的。温度升高,化学平衡常数增大还是减小与反应吸放热有关。
3、平衡状态的标志:①同一物质的v正=v逆 ②各组分的物质的量、质量、含量、浓度(颜色)保持不变 ③气体的总物质的量、总压强、气体的平均分子量保持不变只适用于△vg≠0的反应④密度适用于非纯气体反应或体积可变的容器
4、惰性气体对化学平衡的影响 ⑴恒压时充入惰性气体,体积必增大,引起反应体系浓度的减小,相当于减压对平衡的影响 ⑵恒容时充入惰性气体,各组分的浓度不变,速率不变,平衡不移动 ⑶对于△vg=0的可逆反应,平衡体系中加入惰性气体,恒容、恒压下平衡都不会移动
5、⑴等效平衡:①恒温恒压,适用于所有有气体参加的可逆反应,只要...
谁能发下鲁科版化学选修四的目录谢谢了拜托啦
高中化学鲁科版选修四教学资料
高中化学鲁科版选修四教学资料
章节
目录
第一章
化学反应与能量转化(章末归纳整合
课件+章末综合检测)
11
化学反应的热效应(课件+同步练习)
12
电能转化为化学能——电解(课件+同步练习)
13
化学能转化为电能——电池(课件+同步练习)
第二章
化学反应方向限度与速率(章末综合检测+章末归纳整合课件)
21 化学反应的方向(课件+同步检测)
22 化学反应的限度(课件+同步检测)
23 化学反应的速率(课件+同步检测)
下载
24 化学反应条件的优化——工业合成氨(课件+同步检测)
下载
第三章
物质在水溶液中的行为(章末归纳整合课件+章末综合检测)
下载
31 水溶液(课件+同步检测)
下载
32 弱电解质的电离 盐类的水解(课件+同步检测)
下载
33 沉淀溶解平衡(课件+同步检测,含解析)
下载
34 离子反应(课件+同步检测)
选修4化学
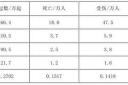
CH3COONa + HCl = CH3COOH + NaCl,0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合,可知醋酸钠过量,混合液中c(CH3COONa)=c(NaCl)=c(CH3COOH)=(0.1mol/L*0.02L - 0.1mol/L*0.01L)/(0.02L + 0.01L)=0.033mol/L。
NaCl = Na+ + Cl-(完全),CH3COONa = CH3COO- + Na+(完全),CH3COOH = CH3COO- + H+(可逆),CH3COO- + H2O = CH3COOH + OH-(可逆),由于题目说溶液显酸性,说明醋酸的电离程度比CH3COO-的水解程度大,所以:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),选B。而根据电荷守恒表达式:c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)可知D也是错的。
延伸阅读:
谁知道怎么学好高中化学选修三人教版(1)、首先是要有兴趣(废话,可忽略): 爱因斯坦说兴趣是最好的老师,不同物质之间的转化其实是很神奇的,生活离不开化学; (2)、其次是学习方法: 多归纳总结,最好把一类或者一些重要而又...
人教版化学选修3怎样学好(1)、首先是要有兴趣(废话,可忽略): 爱因斯坦说兴趣是最好的老师,不同物质之间的转化其实是很神奇的,生活离不开化学;(2)、其次是学习方法: 多归纳总结,最好把一类或者一些重要而又容易...
高中生物选修3知识点整理生物会考 必修3 随静 细胞外液(即内环境):血浆(多蛋白质)、组织液和淋巴 内环境稳态与细胞代谢有关,并在神经调节和体液调节/免疫调节的共同作用下,各系统(内分泌系统、免疫系统)分工...
高中选修科中生物和化学哪个容易学个人认为化学稍微难一点,所以先说化学: 如果是新教材的话(其实各版本的教材知识点都差不多的): 《有机基础》最简单,只要别被吓晕就行,其实就几个基团而已,有相同基团的物质都具有相...
论文急用各位有没有关于绿色化学的论文啊选修课马论文急用各位,有没有关于绿色化学的论文啊,选修课 水性PU在纺织和印染助剂方面的应用越来越广泛。如用作染色助剂、涂料印花粘接剂、柔软与防皱整理剂、抗静电和亲水整理剂等,...
新课改高中物理选修33气体部分我就是辽宁高3的,协作校的~呵呵。 高考的令早就下来了啊.我们练习册和复习方向都已经定下来了。 现在初步定的是,3-3和3-4是选考,要求考生从中2选1做答,选考物理部分共15分。考...
求高中语文选修先秦诸子选读导学教程的答案急!谢!先秦诸子散文概论 先秦诸子包括儒、墨、名、法、道、阴阳等,在本课程中,我们将主要学习儒、道、墨、法四家的著作。 下面就儒、道、墨、法四家及其代表人物作一些简介。 1、儒...
高中物理和化学必修和选修的全部必考知识点高中物理和化学必修和选修的全部必考知识点,高考化学重要知识点总结:化学 一、物理性质 1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色...
高中数学选修12的基础知识有哪些高中数学选修12的基础知识有哪些,高中数学选修22知识点:5 那么y尖=1,它就读作b尖) b尖=(116-5*3*6.6)÷(55-5*3的平方)=1.7*3=1,所以就有误差,y尖=b尖*x+a尖 可写作y=bx+a+e(e叫做随机...